LERNEN über Lungenkrebs
FÖRDERT die gemeinsame Entscheidungsfindung bei der Behandlung.
Wenn bei Ihnen oder einer geliebten Person eine lebensverändernde Krankheit wie Lungenkrebs diagnostiziert wurde, fühlen Sie sich möglicherweise überwältigt oder verängstigt. Diese Website kann Ihnen helfen, sich in Ihrer Diagnose zurechtzufinden – einschließlich der Frage, welche Art von Lungenkrebs Sie haben könnten und wie dies Ihre Behandlung beeinflusst. Die hier bereitgestellten Informationen können Ihnen helfen, eine aktive Rolle bei Ihren Therapieentscheidungen einzunehmen.

Warum bei Lungenkrebs getestet werden sollte
Krebs entsteht, wenn aus gesunden Zellen durch genetische Veränderungen Tumorzellen werden. Diese können dann wuchern und sich im Körper ausbreiten. Die genetischen Unterschiede der Tumorzellen können in einigen Fällen als Angriffspunkte für eine gezielte Therapie genutzt werden.
Es hat sich gezeigt, dass diese „zielgerichteten Therapieansätze“ bei vielen Patienten bessere Erfolgsaussichten bieten als z.B. eine Chemotherapie, da Tumoren gezielter angegriffen werden. Verwendet werden dabei Wirkstoffe, die in zelluläre Prozesse eingreifen, die durch genetische Veränderungen entstehen.
Die Anwendung zielgerichteter Krebstherapien setzt jedoch voraus, dass zuvor ein molekularpathologischer Test des Tumorgewebes durchgeführt wird. Dabei wird untersucht, ob in den Tumorzellen genetische Veränderungen vorhanden sind, die das Tumorwachstum beeinflussen und für die es ein passendes Medikament gibt.
Zielgerichtete Medizin in der Krebstherapie
gesunde Zelle
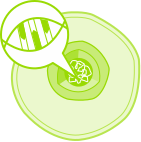
Zellkern mit intakter DNS
intakte DNS
Genänderung/ -mutation
Personalisierte Medizin in der Krebstherapie
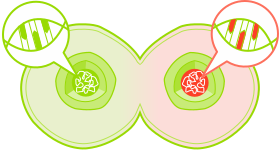
gesunde Zelle
Genänderung/ -mutation

Genetisch veränderte Tochterzellen vermehren sich. Durch weitere zusätzliche genetische Veränderungen in diesen Zellen, kann dann im Verlauf Krebs entstehen.
Personalisierte Medizin in der Krebstherapie

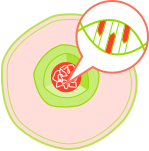
Genetisch veränderte Zellen vermehren sich.

Durch weitere zusätzliche genetische Veränderungen in diesen Zellen, kann dann im Verlauf Krebs entstehen.
Personalisierte Medizin in der Krebstherapie

Wenn eine Zelle fünf bedeutende genetische Veränderungen, sogenannte Driver-Mutationen, durchlaufen hat, drohen die molekularen Irrläufer, die letztlich das Tumorwachstum befeuern. Diese Veränderungen betreffen Gene, die normalerweise die Zellteilung kontrollieren oder DNA-Schäden reparieren.
Man spricht von Krebs, wenn diese mutierten Zellen beginnen, sich unkontrolliert zu vermehren und in gesundes Gewebe einzudringen. Dies führt zur Bildung von Tumoren, die das normale Funktionieren des Körpers beeinträchtigen können.
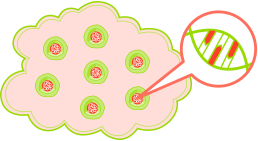
Personalisierte Medizin in der Krebstherapie


diagnostische Testung der Krebszellen
Behandlung mit Medikament, das auf das genetische Profil des Tumors ausgerichtet ist.


Was getestet wird - Biomarker
Durch die Bestimmung sogenannter Biomarker lassen sich innerhalb der Tumorzellen Moleküle identifizieren, die als Angriffspunkte für zielgerichtete Medikamente dienen.
Was sind Biomarker?
Biomarker sind Zellen, Proteine oder Gene in Tumoren, die sich in Körperflüssigkeiten wie Blut oder im Gewebe nachweisen lassen. Sie ermöglichen Rückschlüsse auf Krankheiten oder auf Varianten einer Krankheit, beispielsweise besondere Krebsarten.
Warum werden Biomarker in der Krebsdiagnostik eingesetzt?
Mit Biomarkern lässt sich zum Beispiel herausfinden, ob eine bestimmte Therapie bei einer bestimmten Krebsart wirken kann. Manche Biomarker ermöglichen außerdem eine Abschätzung der Prognose über ein mögliches Rezidiv (Rückfall) und die voraussichtliche Tumorentwicklung.
Kennt die moderne Medizin Biomarker für alle Krebsarten?
Nein, aber in vielen Fällen werden Biomarker benutzt, um die passende Therapie zu finden. Beim nicht-kleinzelligen Lungenkrebs lassen sich bei mehr als der Hälfte der untersuchten Patienten Biomarker nachweisen.
Biomarker in der Diagnosik
Patient
Tumorgewebeprobe, ggf. Blutprobe
Analyse und Bestimmung von Biomarken
Auswahl der personalisierten Behandlung gemäß Biomarker
Biomarker sind ein wichtiger Baustein der zielgerichteten Medizin. Im Rahmen der Diagnose werden unter anderem Gewebe- oder Blutproben auf bestimmte organische Substanzen untersucht – etwa besondere Zellen, Gene oder Proteine. Solche Biomarker können zum Nachweis einer Erkrankung herangezogen werden. Zudem kann mittels Biomarker-Test vor der Behandlung untersucht werden, ob ein Medikament bei einem Patienten voraussichtlich eine Wirkung erzielen wird.
Nachweisbare genetische Veränderungen beim Lungenkrebs.
Ein Biomarker-Test beim Arzt ist wichtig. Er zeigt, ob bestimmte Merkmale im Tumor vorliegen. Diese Informationen können dabei helfen, die passende Behandlung für Ihre Art von Lungenkrebs auszuwählen.


Zur Behandlung von nicht-kleinzelligem Lungenkrebs stehen in der Praxis Medikamente zur Verfügung, die gezielt bei bestimmten genetischen Veränderungen eingesetzt werden.
EGFR - Wachstumsfaktorrezeptor auf der Oberfläche vieler Zellen. Kann bei einer aktivierenden Mutation eine Zellwucherung auslösen.
ROS1 - Ähnlich wie bei ALK kann dieses Molekül das Wachstum von Krebszellen auslösen, wenn es durch Fusion mit einem anderen Gen dauerhaft aktiviert wird.
ALK - Ein Rezeptor unbekannter Funktion, der bei Erwachsenen nur in wenigen Geweben nachzuweisen ist. ALK kann jedoch eine Wucherung von Zellen auslösen, wenn es durch Fusion mit einem anderen Gen, zum Beispiel EML4, dauerhaft aktiviert wird.
PIK3CA - Ein Enzym, das an der Signalübertragung in der Zelle beteiligt ist und Wachstumssignale transportiert. Kann durch eine Mutation des PIK3CA-Gens überaktiviert werden.
KRAS - Protein im Inneren von Zellen, welches Wachstums- und Zellteilungssignale vermittelt. Kann bei einer Mutation ebenfalls ein unkontrolliertes Zellwachstum bewirken.
FGFR1 - Wachstumsfaktorrezeptor, der bei einer Mutation des FGFR1-Gens eine Überaktivität auslösen kann.
BRAF - Enzym, das an der Signalübertragung für das Zellwachstum beteiligt ist. Eine Mutation des BRAF-Gens kann zu einer Überaktivierung des Signalwegs und unkontrolliertem Zellwachstum führen.
PD-L1 - Ein Enzym, dass die körpereigene Immunreaktion unterdrückt. Vermehrtes Auftreten von PD-L1 auf Tumorzellen kann dazu führen, dass das Immunsystem die Krebszellen nicht mehr als 'körperfremd' erkennt und somit auch keine Abwehrmechanismen entwickelt.
HER2 - Wachstumsfaktorrezeptor, über den Wachstumssignale ins Innere der Zelle geleitet werden. Bei Veränderungen im Bereich des HER2-Gens befinden sich auf den Tumorzellen besonders viele Wachstumsfaktorrezeptoren, wodurch die Krebsentwicklung angeregt wird.
NTRK - Eine genetische Veränderung, die auftritt, wenn ein Stück des Chromosoms, das ein Gen namens NTRK enthält, abgetrennt wird und sich mit einem Gen auf einem anderen Chromosom verbindet. NTRK-Genfusionen führen zu abnormalen Proteinen, den so genannten TRK-Fusionsproteinen, die das Wachstum von Krebszellen verursachen können.
MET - Wachstumsfaktorrezeptor auf der Zelloberfläche, über den die Signale des so genannten Hepatocyte Growth Factor (HGF) weitergeleitet werden.

Wie getestet wird
Bei Verdacht auf Lungenkrebs sind in der Regel einige diagnostische Untersuchungen erforderlich. Ein zentraler Bestandteil ist in der modernen Lungenkrebstherapie auch die molekularpathologische Analyse des entarteten Lungengewebes. Sie lässt sich grob in drei Schritte einteilen: Biopsie, Pathologische Diagnostik, Auswertung.
Biopsie
Für die molekularpathologische Analyse ist es ideal, Gewebeproben zu gewinnen. In der Regel findet die Biopsie in einem spezialisierten Krebszentrum oder in der Klinik statt. Nach einem Krebsbefund kann auch eine erneute Biopsie notwendig werden, um die Art des Tumors genauer zu bestimmen.
Neben der klassischen Gewebebiopsie kann bei Verdacht auf Lungenkrebs oder bei bekannten Tumorerkrankungen auch eine sogenannte Liquid Biopsy (Untersuchung von Köperflüssigkeiten, wie z.B. Blut oder Urin) durchgeführt werden. Diese Methode ermöglicht es, genetische Veränderungen des Tumors nicht-invasiv nachzuweisen. Die Liquid Biopsie ist besonders hilfreich, wenn eine Gewebeentnahme schwierig oder risikoreich ist, oder wenn eine Verlaufs- oder Resistenzüberwachung unter einer bestehenden Therapie erfolgen soll. Auch hier werden die Ergebnisse durch spezialisierte Labore analysiert und anschließend dem behandelnden Arzt zur Verfügung gestellt. Die Ergebnisse der Liquid Biopsy können wichtige Hinweise für die Auswahl oder Anpassung einer zielgerichteten Therapie liefern. In Deutschland wird die herkömmliche Analyse von Tumorgewebe (Biopsie) weiterhin als Standardverfahren zur Diagnose von Lungenkrebs eingesetzt, da die Liquid Biopsy noch nicht vollständig etabliert ist.
Pathologische Diagnostik
Anhand einer mikroskopischen Untersuchung der Proben kann ein Pathologe (Facharzt, der unter anderem auf die Beurteilung von Gewebeproben spezialisiert ist) die Erkrankung genauer charakterisieren (z. B. kleinzelliger oder nicht-kleinzelliger Lungenkrebs). Außerdem wird das Gewebe auf Biomarker und genetische Veränderungen untersucht. Dazu werden bestimmte Moleküle aus Zellen der Probe aufbereitet und analysiert oder die Proteine werden direkt auf Gewebeschnitten nachgewiesen.
Auswertung
Die Ergebnisse der molekularen Analysen werden dem behandelnden Arzt zur Verfügung gestellt. Er entscheidet dann, welche Behandlung unter Berücksichtigung der Analysen am erfolgversprechendsten ist. Besprechen Sie mit Ihrem Arzt, welche Behandlung unter Berücksichtigung der Analysen für Sie am erfolgversprechendsten ist.

Gut zu wissen
Die entnommene Probe bleibt auch nach der Biopsie Eigentum des Patienten. Eine langfristige Lagerung oder eine spätere Nutzung der Probe zu Forschungszwecken darf deshalb nicht ohne Ihre Zustimmung erfolgen.
Gewebeprobe
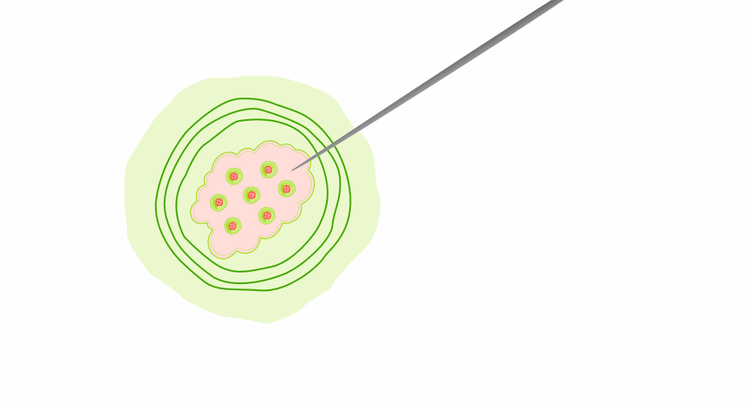
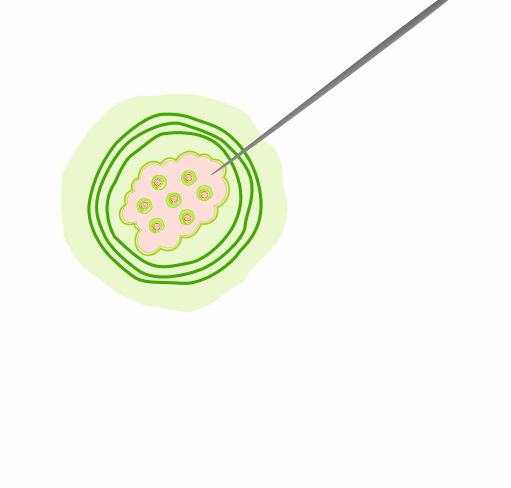
Entnahme einer Gewebeprobe aus dem Tumor zur molekularen Untersuchung auf Biomarker.

Ihr Arztgespräch

Sobald Sie Ihren Biomarker-Status kennen, können Sie gemeinsam mit Ihrem Arzt besprechen, welche Therapie für Sie am besten geeignet ist. Arbeiten Sie eng mit Ihrem Arzt zusammen, um alle möglichen Optionen zu verstehen, bevor Sie eine Therapieentscheidung treffen. Ihr Arzt könnte eine zielgerichtete Therapie empfehlen – entweder allein oder in Kombination mit einer anderen Behandlung.
Je nach Stadium und Art des Krebses, dem Vorhandensein eines Biomarkers und Ihres allgemeinen Gesundheitszustandes kann Ihr Arzt eine oder mehrere der folgenden Behandlungen empfehlen:

Alle Behandlungen haben ihre eigenen Vorteile und Risiken – Ihr Arzt kann Ihnen dazu weitere Informationen geben. Bitten Sie Ihren Arzt, alle Behandlungsmöglichkeiten aufzulisten, für die Sie infrage kommen könnten.
Nutzen sie den Merkzettel zur Unterstützung, sich auf ihr Arztgespräch vorzubereiten und während des Gesprächs Notizen zu machen.

Weiterführende Informationen & Hilfen
Zielgerichtete Medizin

Familienbuch für Betroffene
Medizinische Fachgesellschaften
- Deutsche Krebshilfe
- Deutsche Krebsgesellschaft DKG
- Deutsche Gesellschaft für Hämatologie und Onkologie DGHO
- Deutsche Gesellschaft für Pathologie
- Deutsche Gesellschaft für Pneumologie und Beatmungsmedizin
- European Society for Medical Oncology ESMO
- Berufsverband der niedergelassenen Hämatologen und Onkologen (BNHO)

Podcast für Betroffene und Angehörige
Wissenschaftliche Referenzen
- Krebsinformationsdienst des Deutschen Krebsforschungszentrums Heidelberg;
www.krebsinformationsdienst.de
(zuletzt abgerufen am 25.08.2025) - Cancer Genome, Molecular Profiling of Lung Cancer,
https://www.mycancergenome.org/content/disease/non-small-cell-lung-carcinoma
(zuletzt abgerufen am 25.08.2025) - Griesinger F. et al. Onkopedia Leitlinie „Lungenkarzinom, nicht-kleinzellig (NSCLC)“. Stand: Januar 2025.
- Lindeman NI, Updated Molecular Testing Guideline for the Selection of Lung Cancer Patients for Treatment With Targeted Tyrosine Kinase Inhibitors: Guideline From the College of American Pathologists, the International Association for the Study of Lung Cancer, and the Association for Molecular Pathology. J Mol Diagn 2018; 20:129


